
令和3年12月18日
京都府医師会館
Web配信(ハイブリッド)

総合司会
はらしまクリニック
原島 伸一 先生

講演1
福岡大学医学部
内分泌・糖尿病内科
川浪 大治 先生

講演2
市立長浜病院
ヘルスケア研究センター
石田 均 先生
福岡大学医学部内分泌・糖尿病内科学
教授 川浪大治 先生
2型糖尿病の食事療法を巡っては、様々な議論が続いている。特に適正な栄養素摂取比率については定まった見解が得られていない。高タンパク質あるいは高脂肪食の効果を長期的に追跡できた研究がほとんど存在しないため、有効性や安全性について結論づけるだけの根拠に乏しいのが実情である。本稿では、これまでに明らかになっていること、そうではないことを整理しつつ、糖代謝および糖尿病合併症管理の観点からタンパク質、脂肪摂取量の意義を考えてみたい。
食べ過ぎないことは健康増進に寄与すると考えられる。アカゲザルを用いた研究においてエネルギー制限を30年にわたって行ったところ、自由に摂食させた群と比較して、がん、心血管疾患、インスリン抵抗性、糖尿病の発生が有意に低下したことが報告されている(Nat Commun,2017;8:14063)。このことは少なくとも適切なエネルギー摂取が望ましいことを示している。では、どのような食事パターンが2型糖尿病の発症リスクになるかについて考えてみたい。健康な食事パターン(野菜、果物、魚が多い)では発症リスクが低下する一方、不健康な食事パターン(赤身肉、加工肉、高脂肪の乳製品、揚げ物が多い)では発症リスクが上昇することがメタ解析によって示されている(J Nutr, 2017.147:1174)。また、米国心臓病学会は2021年に心血管疾患予防に望ましい食事パターンとして図1のような提言を行っている(Circulation,2021;144:e472)。これらの知見から、タンパク質や脂肪摂取量は2型糖尿病や心血管疾患のリスクと密接な関係があることが示唆される。

日本人の2型糖尿病は追加インスリン分泌低下を背景として食後高血糖から発症すると考えられているが、これには摂食速度が関与している可能性がある。我々は長崎県壱岐市の一般健診受診者4,800人を対象に検討を行った。その結果、摂食速度が速い群では遅い群に比べて糖尿病の発症リスクが2倍に及ぶことを報告した(J Clin Med,2021;10:1949)。早食いによって食欲抑制ホルモンやGLP-1の分泌低下することが関与しているのではないかと考えている。このように摂食スピードは大切であるが、これに加えて食べる順番も重要である。ベジタブルファーストは良く知られているが、「おかず」から先に食べることも食後高血糖の抑制に有効であることが示されている(BMJ Open Diabetes Res Care,2017;5:e000440)。朝食をしっかり食べる習慣を指導することも重要であると考えられている。朝食を抜く習慣があると肥満や動脈硬化リスクが高くなることが報告されている(J Am Coll Cardiol,2017;70:1833)。また、体重管理の面でも朝食にエネルギー配分を多くもってくることが有用であることが示されている(Obesity,2013;21:2504)。
タンパク質摂取量と2型糖尿病発症リスクを検討した研究では、タンパク質摂取量Q1 (70 g/day; 12.8%E)~Q5 (110 g/day; 21.6%E)の五分位に分けた場合、最も摂取量が多いQ5ではQ1よりも2型糖尿病発症リスクが17%増加したことが報告されている(Diabetes Care,2014;37:1854)。このことは、タンパク質摂取量がエネルギー比で20%を超えると糖尿病発症リスクが増加する可能性を示唆している。一方で、2型糖尿病患者における高タンパク食(20-30%E)と低たんぱく食(15-20%E)が血糖コントロールに与える影響を検討したメタ解析では、両群間のHbA1cに有意差はなかったと報告されている(Medicine,2018;97:13149)。ただ、高タンパク食で長期間フォローできた研究がほとんど存在せず、2型糖尿病管理における高タンパク食の影響は結論付けることが出来ないのが現状である。タンパク質は摂取量のみならず、その内容が重要である。植物性タンパク質の摂取量増加は糖尿病発症リスクを低下させることが報告されている(Nutrients,2021;13:1217)。さらに、一般住民を対象とした検討では赤身肉(加工品を含む)の摂取量が多いと死亡リスクが増加するが、鶏肉や魚ではそのような傾向が認められなかったことが報告されている(JAMA Intern Med,2020;180:503)。本項目の内容を図2に示した。

高タンパク食は血漿高浸透圧の上昇に伴い腎血流を増加させるため、糸球体過剰濾過を助長して糖尿病性腎症の発症や進展を促進するのではないかという懸念が従来からあるが、明確なエビデンスはない。一方で、糖尿病性腎症におけるタンパク制限についても有効であるとするエビデンスに乏しい(BMJ,2013;3:e002934)。これは、タンパク制限の実施は長期間続けることがアドヒアランス上難しいことも一因ではないかと考えられる。タンパク制限を行う場合には0.6-0.8 g/kg(目標体重)で計算するが(Diabetol Int,2020;11: 224)、これは日本人の食事摂取基準による必須摂取量とタンパク制限の腎保護効果に関するデータに基づいて提唱された数値である。我々は、動物性タンパク質や加工食肉の摂取量増加に伴い、リンの過剰摂取が腎症の発症・進展に関与しているのではないかと考えている。リンは生体に必須のミネラルであるが、過剰摂取が腎や心血管の老化や線維化を促進することが報告されている(Kidney Blood Press Res,2020;45:80)。当研究室ではリンの過剰摂取を予測するバイオマーカーとしてFGF23の可能性に着目しており、腎機能正常の1型糖尿病患者においてFGF23とeGFRの間には相関があることを確認している(投稿中)。このほか、マウスで検討では高タンパク食がオートファジーの抑制を介して動脈硬化の形成を促進することが報告されている。食品として考えた場合に、タンパク質という単一の栄養素を摂取するわけではないので、付随する栄養素やミネラルなども考慮する必要があるのかもしれない。少なくとも、糖尿病合併症とのバランスを考えた場合にタンパク質の過剰摂取は推奨できない。エビデンスが揃っていない現時点では、タンパク質摂取量は20%E以下にとどめておくことが安全であると言えるのではないだろうか。本項目の内容を図3に示した。

米国で行われた肥満者を対象とした研究では、総エネルギー摂取量を2200kcalから1700kcalに500kcal減じる効果が検証されている。この際に、脂肪摂取量は30%E以下に設定することで糖質制限と同等の減量効果が得られることが報告されている(JAMA,2018;319:667)。血糖コントロールの観点からは、総脂肪摂取量が多いほどHbA1cは高く、多価不飽和脂肪酸/飽和脂肪酸比が高いほどHbA1cが低いことが示されている(Diabetes Care,2001;24:1911)。このことは、タンパク質と同様に脂肪も摂取量のみならず質が重要であることを示唆している。摂取増加を避けるべきものとしてトランス脂肪酸が挙げられる。トランス脂肪酸は、ショートニングやマーガリンに多く含まれている。トランス脂肪酸の摂取が多いと、2型糖尿病や心血管疾患の発症リスクが有意に増加することが報告されており(BMJ,2015;351:h3978)、1型糖尿病患者における検討においても焼き菓子の多い食事パターンでは血糖コントロールが悪化することが示されている(Nutrients,2021;13:1035)。ketogenic diet(脂肪70%E)では結果として高脂肪食となるが3か月ほどの短期間の試験では、血糖コントロールが改善し、有害事象は認められていない(J Diabetes Res,2019;2019:8681959)。しかし、やはり長期間での検討がないため安全性を担保するだけの根拠に乏しい。
オメガ3脂肪酸の摂取については、最近のメタ解析の結果からサプリメントでの摂取は血糖コントロールに何ら影響を与えないことが示されている(BMJ,2019;366:l4697)。しかしながら、糖尿病患者が約60%を占める大規模臨床試験において1日4グラムのEPA投与(スタチン併用)が心血管イベントを抑制することが報告されている(N Engl J Med,2019;380:11)
以上、述べてきたようにタンパク質や脂肪の適正摂取量を結論付ける根拠がいまだ乏しいのが現状である。また、食事療法に関する研究の多くは観察研究であり、介入研究は少なくかつ短期間での検討の場合が少なくない。エビデンスの解釈にはこの視点も重要であると思われる。しかし、これまでの研究結果からは、タンパク質は20%E、脂肪は30%Eを超えないことが好ましいと考えられる(図4)。本領域における今後の研究の発展に期待したい。

市立長浜病院ヘルスケア研究センター
センター長 石田 均 先生
今回の学術講演会のテーマである「適切な三大栄養素バランスを考える」ことへの重要性を鑑みるにあたり、まずは私自身の素朴な疑問でもある「そもそも現時点において、科学的根拠のある適切な炭水化物の摂取基準があると言えるのだろうか?」の命題について、私なりの考えを述べてみたいと思います。すなわち一つにはその「量的な」側面からの疑問として、日本糖尿病学会からの「糖尿病治療ガイド2020-2021」に記載のある指示エネルギー量の炭水化物40%からの初期設定は、果たして科学的な面からも妥当と言えるのだろうか?またその一方で「質的な」側面からの疑問として、同じ炭水化物の単糖類でも、グルコース(ブドウ糖)とフルクトース(果糖)の栄養素としての取り扱いを、どのように臨床の現場で区別して考えて行けばよいのだろうか?そしてこれらの素朴な疑問について、今回の講演会にご参加の皆様方も、ともにこの機会をきっかけとして考えを巡らせていただければ幸いです。
日常診療の場で広く活用されている日本糖尿病学会からの「糖尿病診療ガイドライン2019」においては、その「3.食事療法」の章のなかで望ましい栄養素摂取比率について、糖尿病の予防や管理のために、これを具体的に設定する明確なエビデンスが、残念なことながら未だに得られていないことが述べられています。また炭水化物の摂取量と糖尿病の発症リスクや管理状態との関連性についても、未だにそれらに対する確認が十分になされているとは言えません。
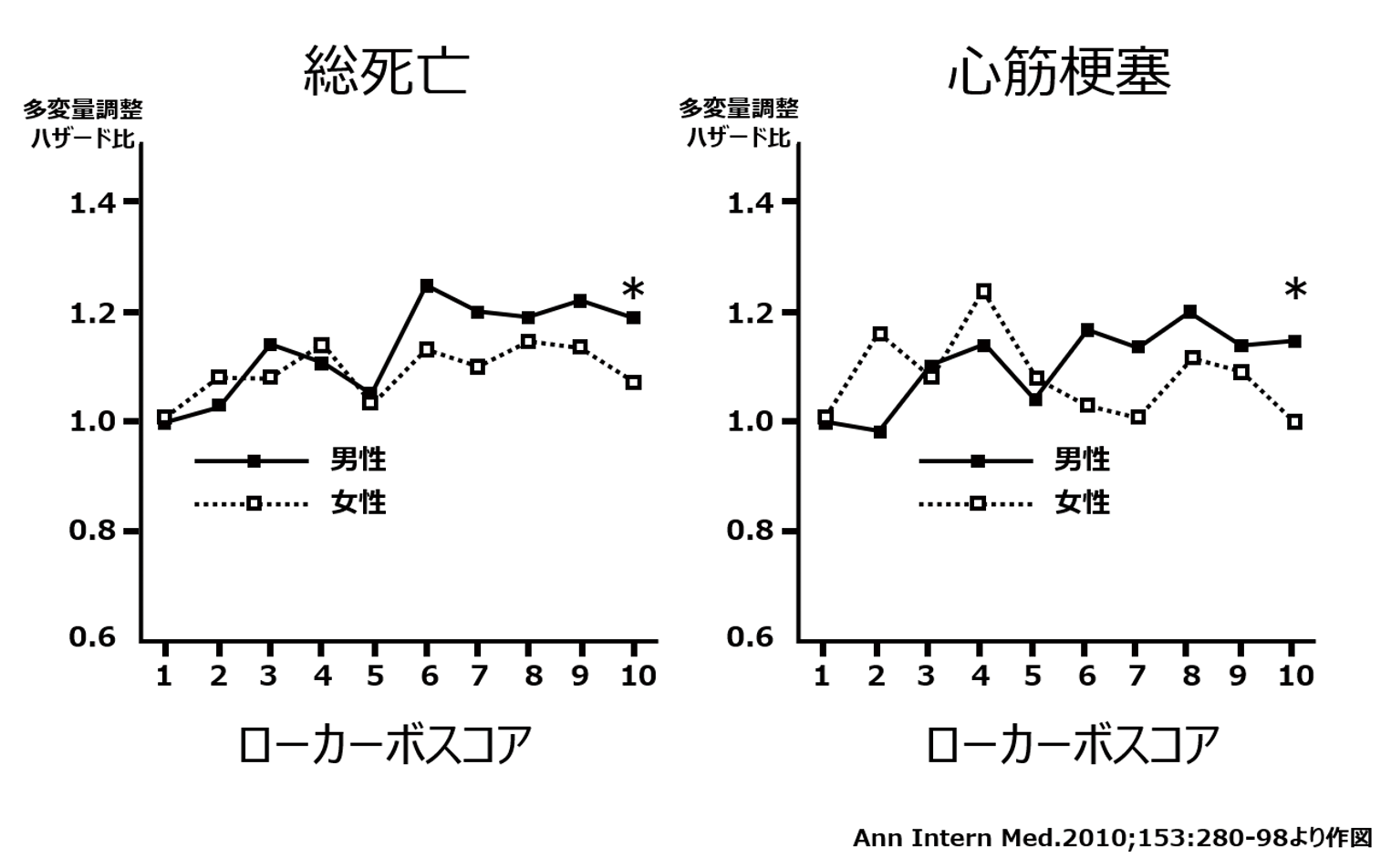
しかしながら、これまでにも一般的な食事療法の可能性の一つとして取り上げられてきた、いわゆる「低炭水化物食」は本当に身体に良いのでしょうか?そしてその摂取比率が、例えば40%でも大丈夫なのでしょうか?約10年前のヒトを対象とした前向きコホート研究(Ann Intern Med 2010;153:289)において、摂取比率60%の対照群 (スコア1) に対して、その比率をおよそ3分の2の40%あたりにまで減らした「低炭水化物食」群 (スコア10) では、数年後に死亡率や心筋梗塞の発症が明らかに上昇すること (図1) 、またそのサブ解析によって同じ「低炭水化物食」群でも、おかずの内容として動物性由来の食材が多ければ多いほど、植物性由来の食材が多い場合に比べて、死亡率や心筋梗塞がさらに高まることが報告されました。
そこで私達は、この食事での糖質制限が身体内での糖・脂質代謝機構に影響を及ぼす可能性について、動物実験により解明を試みました。(PLoS One 2014;9:e104948)
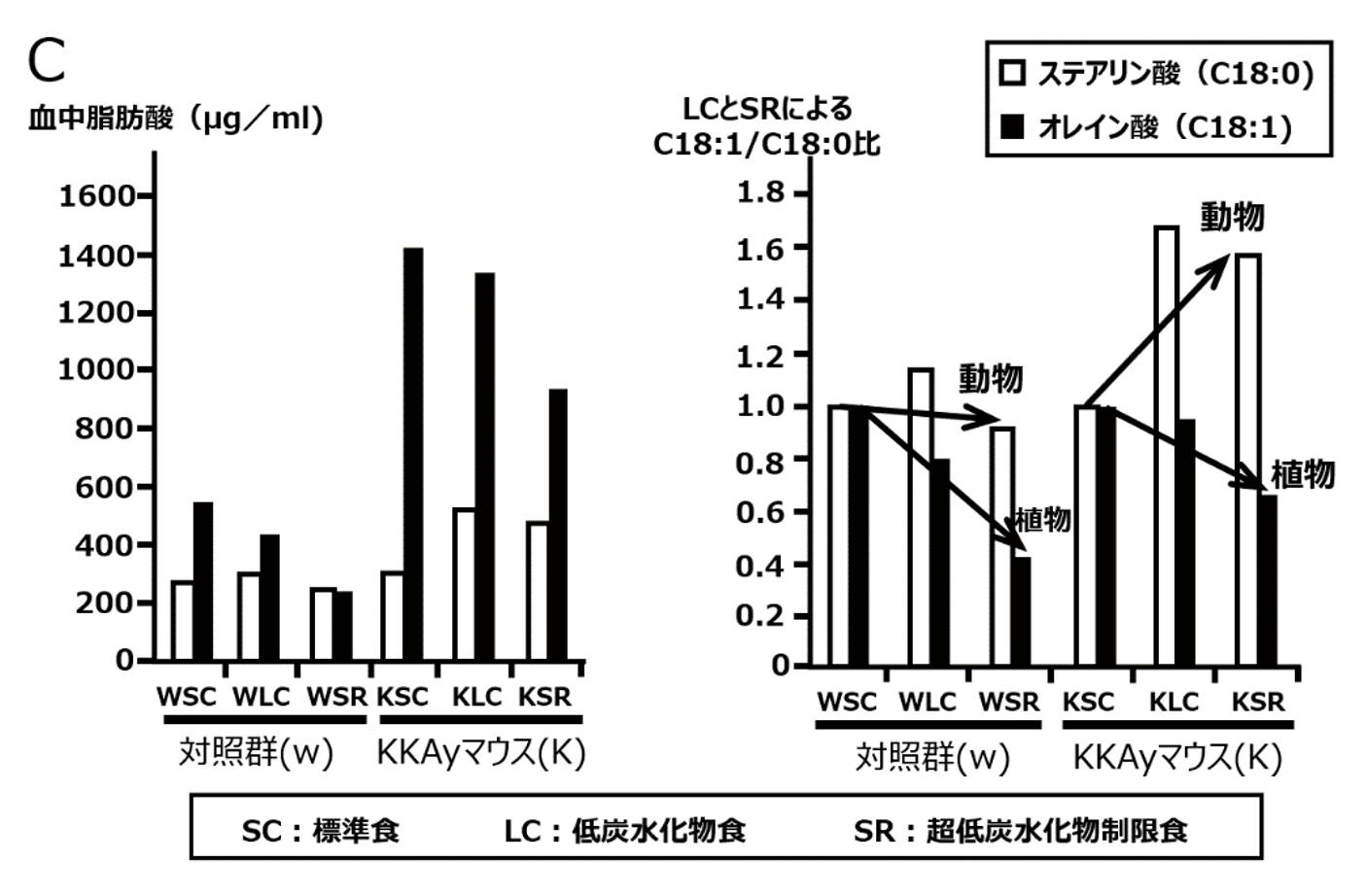
この実験に用いる糖質制限食としては、対照の標準食(SC)が含む炭水化物エネルギー比63%に対し、中程度の低炭水化物食(LC)では炭水化物を先ほどの臨床データに相当する38%に設定して、その分のタンパク質や脂質の含量を増加させています。またさらに高度の超低炭水化物制限食(SR)では、いわゆる「スーパー糖質制限食」に匹敵する比率である18%として、一方で脂質についてはLC食と同一にいたしました。そしてこれらの食事をペアフィーディングの条件下で、正常の対照群ならびに肥満2型糖尿病マウスであるKKAyマウスの2群に対し、ともに6週間にわたり経口投与しました。そしてその結果としては、内因性の脂質代謝機構の変化に関して、飽和脂肪酸(炭素数C:18)のステアリン酸と、同じくC:18の一価不飽和脂肪酸であるオレイン酸との血中分画の比率について、対照群ならびにKKAyマウスの標準食(SC)での血中濃度をそれぞれ「1」に標準化して、低炭水化物食(LC)や超低炭水化物制限食(SR)での推移を観察したところ (図2) 、特に肥満2型糖尿病のKKAyマウスにおいて顕著に観察されましたが、動物由来の飽和脂肪酸の割合がだんだん増加し、その一方で植物由来の一価不飽和脂肪酸が逆に減少して、生体内での動脈硬化をきたし易くする病態への移行促進を示唆する所見、すなわち飽和脂肪酸(動物由来)を一価不飽和脂肪酸(植物由来)へと変換する酵素である「SCD-1」の相対的な活性低下を示す所見が認められました。
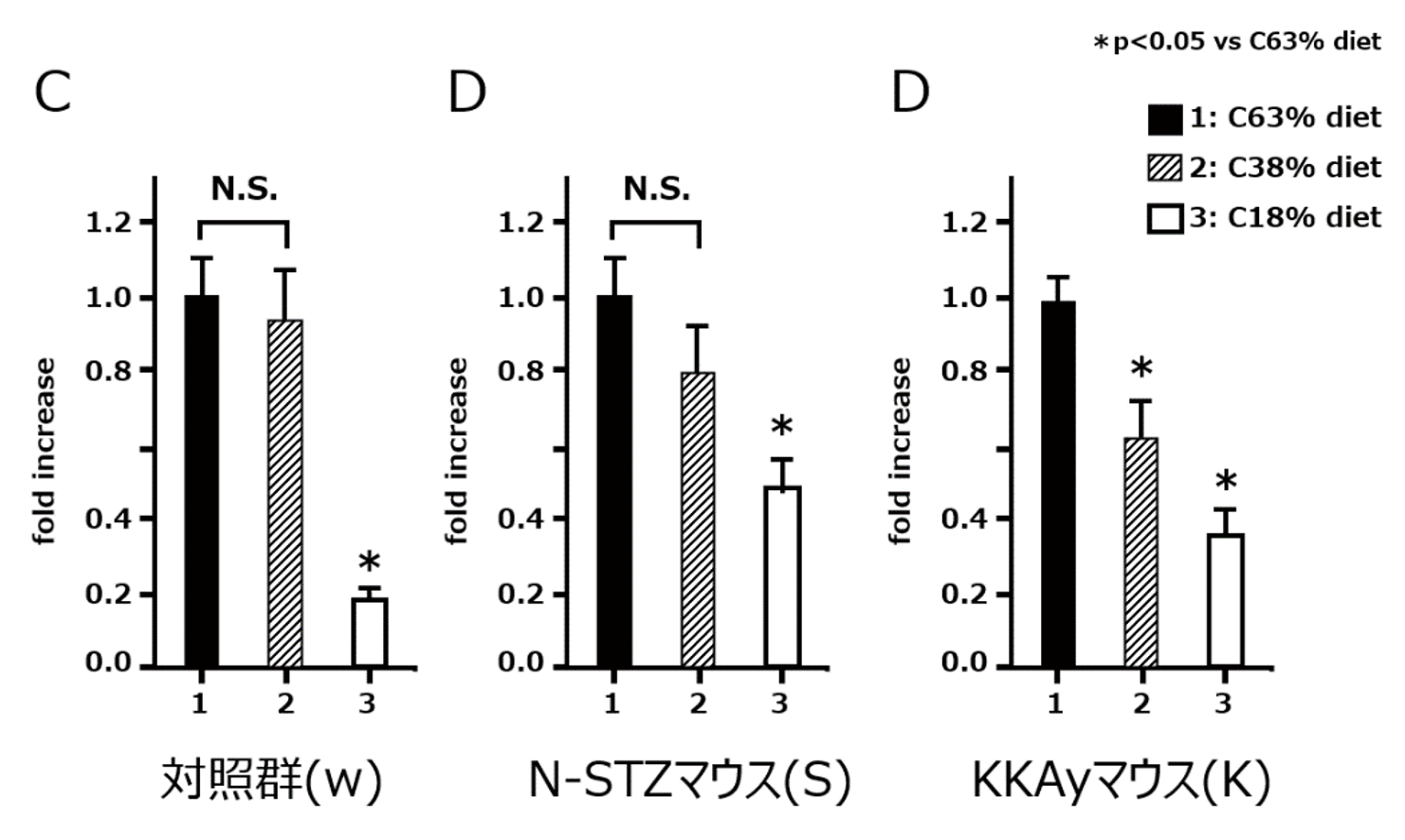
これらの成績は、同様に炭素数C:16の脂肪酸の組み合わせでも、いずれの場合も同様に再現性を持って、対照群ならびにKKAyマウスの両者において、ともに糖質制限による相対的なSCD-1酵素活性低下の存在を示唆する成績が得られました。さらにこの活性の低下が、肝臓でのSCD-1遺伝子の発現調節機構の変化によることも併せて明らかになりました(図3)。そしてなかでも肥満2型糖尿病モデルのKKAyマウスでは、すでに炭水化物40%程度の中程度糖質制限下において、この遺伝子の発現が明らかに低下していました。すなわち、元々の病態から動脈硬化のリスクが高く、かつ食事のなかの糖質の割合を減らす傾向が強い肥満2型糖尿病のグループほど、この糖質制限による影響をさらに受けやすいという「不適切な」事実が推測されました。
以上のことから、食事のなかの糖質の割合を減らし過ぎると、その結果として身体のなかでの脂質代謝機構にも変化 (SCD-1遺伝子の発現低下) を生じること、そして血中の一価不飽和脂肪酸と比較して相対的に飽和脂肪酸の濃度が増加することで、かえって全身での動脈硬化のリスクが高まってしまう可能性が示されました。
また最近のいくつかの報告から、血中のFGF21が脳の食欲中枢からのフィードバック機構(Cell Metab 2016;23:335)を介して、食事からの炭水化物の摂取量をうまく適正な範囲内に調整しているメカニズムの存在が提唱され、「Liver-to-brain Hormonal Axis」との名称が与えられています。この複雑な制御機構の詳細なるメカニズムとその生体内で有する意義の解明が、一日も早く待たれるところです。
それでは同じ炭水化物のなかの単糖類であるグルコース(ブドウ糖)とフルクトース(果糖)とは、果たして栄養学的に全く同一と考えて良いのでしょうか?例えば代表的な二糖類の一つであるスクロース、すなわちショ糖(蔗糖、しょとう)は、小腸壁に存在する消化酵素のサッカラーゼにより加水分解され、その結果として等モルのグルコースとフルクトースを生じます。ただこれら二つの単糖類の生体内での代謝機構は、図4に示しますようにお互いの間で微妙に異なることが知られています。(Nutrients 2021;13:1314)
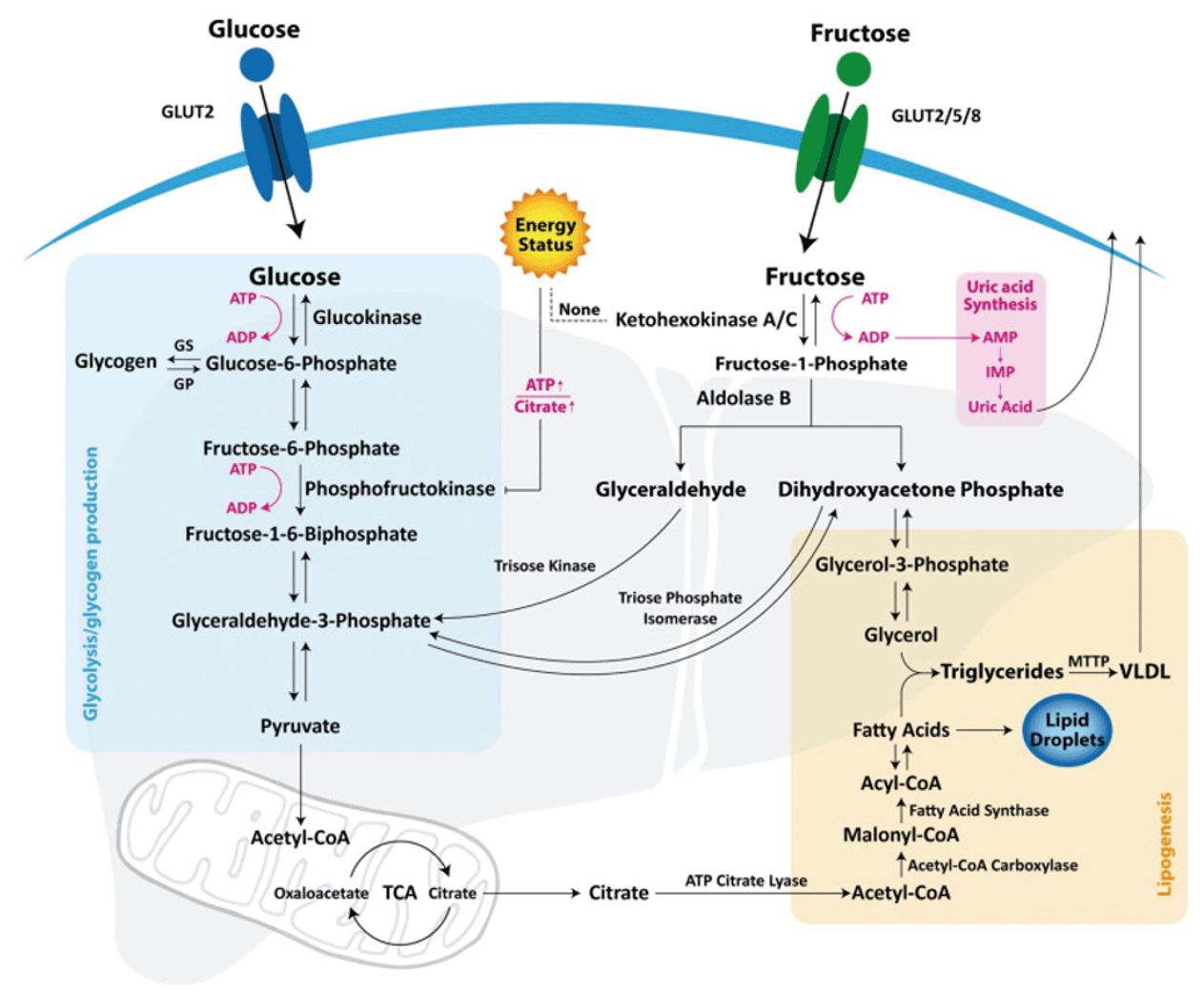
なかでもこの図の右に示しますフルクトースの代謝機構は左のグルコースと比較して、すぐに脂質や尿酸の代謝経路に結び付き易く、実際に動物実験においてもフルクトースの過剰な摂取は、高脂肪食下での内臓脂肪蓄積や脂肪肝形成の更なる促進に働くことが示されています。また興味深いことに、先ほどの血中FGF21は、むしろフルクトースの経口摂取に対して、グルコースよりもさらに強く増加反応を示すことが報告されています。
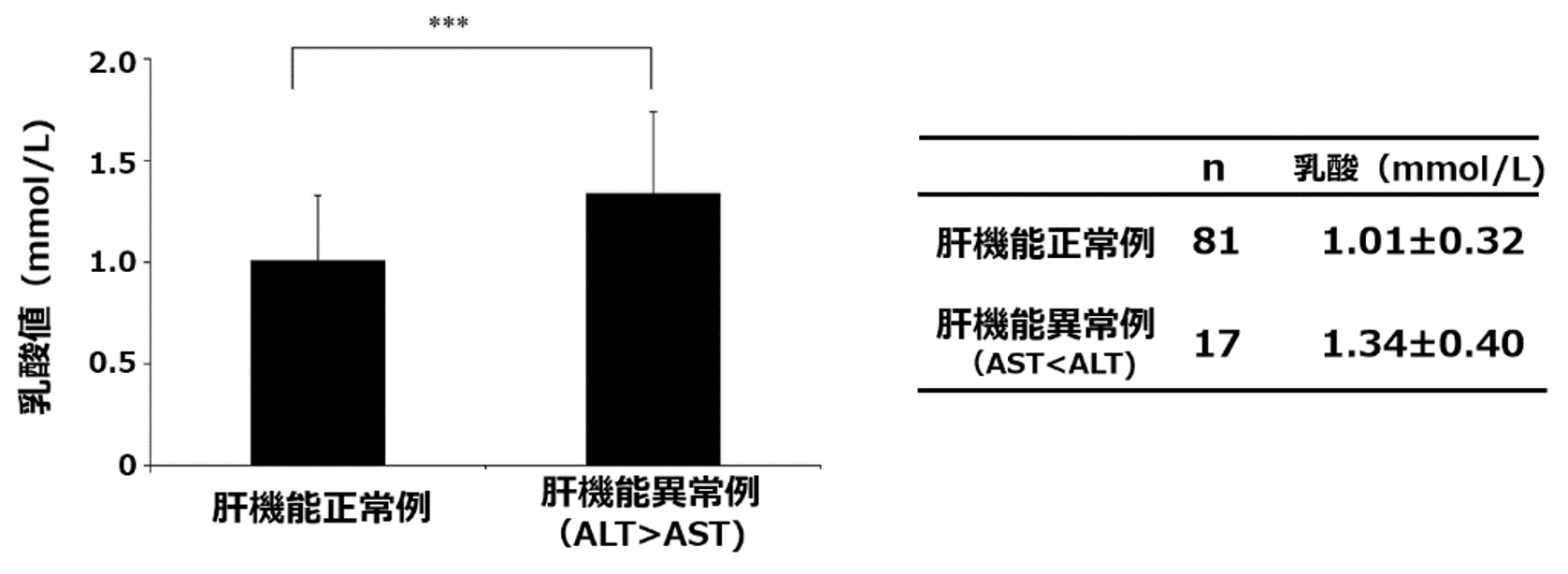
さらにフルクトース代謝と脂質や尿酸生成との関連に加えて、その代謝産物の一つであるピルビン酸からの乳酸生成との関わり、そして慢性炎症の惹起と種々の病態、さらにはインスリン抵抗性などに対する関与についても、最近になり注目がなされています。そこで私達は血中の乳酸値に着目して、なかでも肝障害の予知因子としての可能性について、2型糖尿病症例を対象に予備的な検討を加えてみました。(Diab Res Clin Pract 2019;149:1-8)
そしてその結果の重回帰解析により、血中乳酸値は肝酵素のALT値とかなり強い正の相関を、一方で総ビリルビンとは負の相関を認めることや、ALT優位の肝機能障害を有する症例群において、その予知因子としての可能性が考えられる血中乳酸値の有意な上昇が観察されました。(図5) すなわちフルクトースの過剰摂取による脂肪肝形成の過程のなかに、今回の乳酸生成の代謝経路の少なくとも一部が、同じくフルクトース由来となる尿酸生成の代謝経路とともに、より促進的な方向に介在している事実が推測されます。またこれらの経路は、ともに生体内での酸化ストレス生成系や脂質代謝系に関与する代謝経路の上流に存在することから、脂肪肝に至るまでの病態のなかのごく初期の変化に対する予知因子としても、その臨床的な意義について今後の詳細な検討が待たれます。
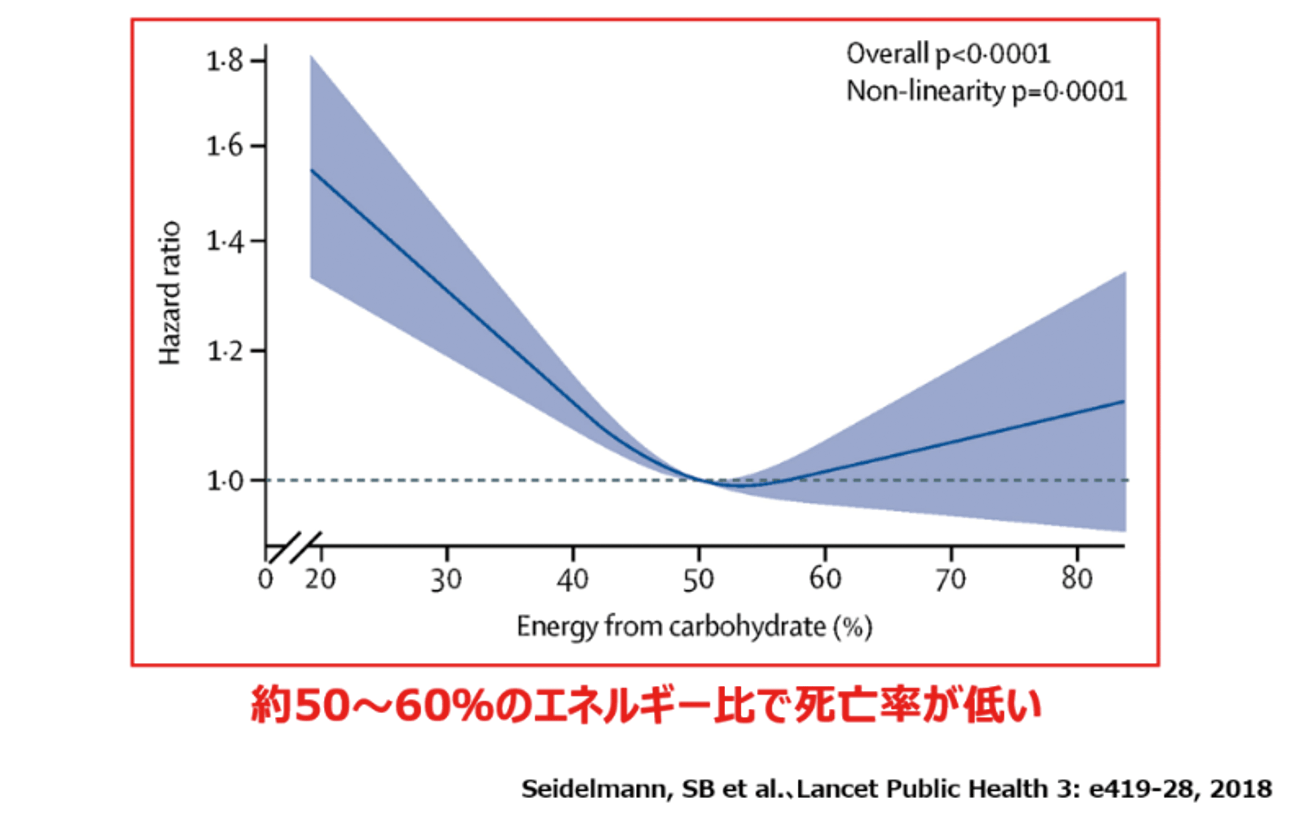
全体で14万人もの規模に及ぶ、世界各地での食事内容をまとめた近年の成績(Lancet 2017;390:2050-62) や、その後の大規模なコホート研究 (図6) の所見から、(Lancet Public Health2018;3:e419-28) 食事からの炭水化物の摂取比率と死亡率との関係に基づいて、今一度改めて私なりの考えを整理してみますと、やはりその「量的な」観点からについては、50~60%程度の炭水化物エネルギー比の割合が、最も妥当なところと思われます。しかしながら一方で「質的な」観点からとなりますと、残念ながら未だにいくつもの課題が残されています。そしてなかでもフルクトースの相対的な過剰摂取に関しては、脂肪肝の形成促進やメタボリックシンドロームの助長などの臨床栄養学的な観点から考えても、さらに臨床的な注意喚起が必要と推察されます。
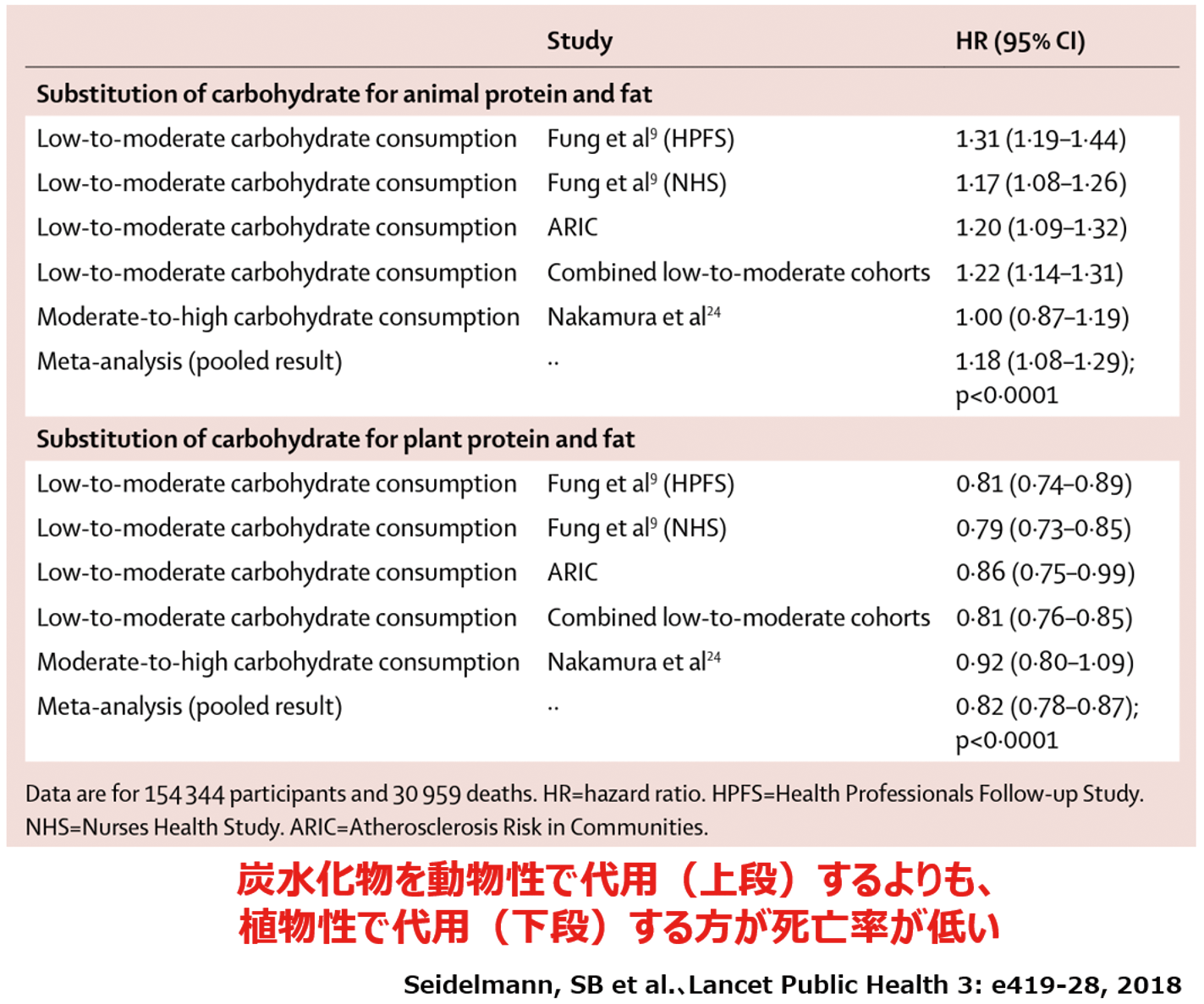
一方で、これまでの多くのコホート研究において、栄養成分としての炭水化物の含量を、動物由来あるいは植物由来のタンパク質や脂質に代用置換した場合の、人々の死亡率に及ぼす影響をまとめたサブ解析の成績では、図7の上半分に示すように炭水化物を動物由来のタンパク質や脂質に変えた場合には、その全ての報告において有意に死亡率が高くなるのに対して、下半分の植物由来のタンパク質や脂質に変えた場合には、全ての報告においてこちらは幸いなことに、有意な死亡率の低下を認めています。すなわち炭水化物の場合とは異なり、タンパク質ならびに脂質に関しましては、これらの栄養成分としての「質的な」側面において、動物由来よりはむしろ「植物由来が望ましい」との決着を、すでに明白に見ているものと思われます。
従来までの栄養摂取基準の作成は、主に疫学調査から得られた外因性栄養素の摂取量調査に関する成績のみに基づいて行われてきました。しかしながらこれからの臨床栄養学の意義を正しく語るためには、単なる外因性の栄養素摂取に関する検討にとどまらず、摂取した栄養素が身体のなかで内因性に変化していく代謝状況の詳細についても、同時に病態栄養学的な側面からの検討を加える必要があるものと思われます。したがって栄養学に携わっている多くの研究者に対して、このような総合的な学問体系を速やかに構築していくことが、人間社会への新たな科学的責務として重く課せられていると日々感じています。
京都糖尿病医会会長
鍵本 伸二
コロナ禍は3年目に入っても収束の兆しがなく、診療でも日常生活でもストレスの多い日々が続いておりますが、会員の先生方におかれましてはいかがお過ごしでしょうか。各種会議や学術講演会もオンラインに慣れてきて、これはこれで案外便利だと感じつつもありますが、やはり対面に比べるとディスカッションが盛り上がりにくく、また地域連携の基本でもある「顔が見える関係」を構築しにくいなど、オンライン形式の限界も実感しております。1日も早く皆様と顔を突き合わせてお話が出来る日常が戻って欲しいと願うばかりですが、講演会などにオンライン参加頂きました際には、是非1人でも多くの先生に質問やディスカッションでお声を発して頂けますよう、お願い申し上げます。
さて、当院では私を含めて12月下旬にスタッフの3回目ワクチン接種を済ませましたので、5月には4回目の接種券が届きました。第6波が落ち着いた様でも感染者数が下がり切らず、早くも増加に転じる兆しがある中で、心優しい当院の看護師たちから「院長も4回目を受けて下さい」とプレッシャーをかけられています。「まだ60歳になってないし、基礎疾患もないから対象外」と断っているのですが、厚労省の見解では運動不足も重症化のリスクファクターとなっていますので、看護師のプレッシャーに負けないよう運動に取り組みたいと思っています。(追記:この原稿を広報担当の豊田先生に送る直前になって、医療従事者は年齢や基礎疾患に関係なく4回目の接種対象にするとのニュースが聞こえてきました)
さて、私の運動といえば登山とサイクリングですが、紙面の賑やかしにサイクリングの話を少々書かせて頂きます。昨年秋の気持ちよく晴れたとある休日、青空に誘われて紅葉狩りサイクリングに出かけました。クリニックを出発して丸太町通を西に走って、嵯峨野から化野を抜けると愛宕神社一の鳥居があります(写真1)。鳥居のすぐ横は鮎で有名な平野屋ですが、その横を左(西)に向かって坂道を上り、六丁峠を越えると保津峡に出ます。対岸を走るトロッコ列車の線路を見ながら保津川に沿って走るとまもなくJR保津峡駅で、道路はここで保津川と別れて支流の水尾川に沿って北上します。緩やかな登り坂を暫く走って道ばたに柚の木が現れると、柚子の里水尾に到着。ここには特産の柚子や柚子胡椒などの自動販売機があり、激辛の「ハバネロ柚子胡椒」をゲットしました。

水尾の集落を過ぎてさらに登り続けると、神明峠があります。山を上って次は下るから「峠」のはずですが、神明峠を過ぎてもまだまだ上りが続きます。「なんでやねん」と心の中でツッコミを入れながら我慢して登り続け、道がやっと下りに転じると程なく視界が開けて美しい棚田が見えてきました。ここは日本の里百選にも選ばれた宕陰(とういん)、愛宕山の西山麓に広がる歴史ある集落で、樒原と越畑の二つの地区からなっています(写真2)。水尾方面から行くと、樒原の次が越畑地区。折角なので有名な越畑フレンドパークまつばらの蕎麦を食べようと、午前11時には着くように走ってきましたが、既に満員で店の横のベンチに行列が出来ていました。なかなか手強い!(写真3)


昼食にありつけそうなところを目指して、日吉ダムのほとりにある道の駅「スプリングスひよし」まで走りましたが、多くの自動車で賑わっていて、施設の中も人があふれかえっていました(写真4)。結局ここでの食事もあきらめて、景色の良い湖畔で持ってきたおにぎりを食べ、帰路はダム湖の東端から桂川を遡って宇津峡を抜けて、周山街道から杉坂、京見峠へ。周山街道に着くころには既に足はヘロヘロでしたが、思いっきり低いギヤを惰性で回し続けて、何とか無事にクリニックまで辿り着きました。免疫力を高めるための運動のはずが、疲れ果ててかえって低下させているかも・・・。

すでに皆様ご承知とは思いますが、2022 年 4 月の診療報酬改定で血糖自己測定器加算の C150-7 血糖自己測定器加算の間歇スキャン式持続測定器によるもの 1250 点が、インスリン製 剤の自己注射を 1 日に 1 回以上行っている入院中の患者以外の患者に適応になりました。GLP1 製剤との配合注射でも同様の扱いになりますが、GLP1 製剤単独では、C150 の 1 ~ 4 の対象(月 60 回以上まで)となりますのでご注意ください。同月にインスリン処方がない場合には、残薬 ありなどのコメントをあらかじめ入れていただけたらと思います。
間歇スキャン式持続測定器による血糖測定と従来の自己血糖測定は同時算定できないルールは そのままですので、両者を併用する場合には、間歇スキャン式持続測定器による測定以外の血糖 測定回数を基準に算定することになります。
ところで、病院勤務をしていると診療報酬制度に疎くなりがちで、また若い先生方やコメディ カルに診療報酬制度を説明するのに苦労しますが、皆様どのように指導されているでしょうか。 日本糖尿病療養指導士認定機構が毎年出版している糖尿病療養ガイドブック(最新版は 2022 年) には、付録のページに糖尿病関連の診療報酬の一覧表や、標準的な治療の患者負担額の記載があ り、大変便利です。また、糖尿病の概念から治療・療養指導に必要な事項が詳しくかつ分かりや すく記載されており、わたくしも日常診療で活用しています。今年度版も税抜き 3150 円と信じ られない安価ですので是非お手元に 1 冊お持ちいただき活用していただければと思います。
(文責:長谷川 剛二)