
令和元年6月29日
京都府医師会館

総合司会
京都桂病院
長嶋 一昭 先生

司会
かぎもとクリニック
鍵本 伸二 先生
京都桂病院 糖尿病・内分泌・生活習慣病センター センター長
長嶋 一昭 氏

はじめに
近年、糖尿病患者数の増加および高齢化により、高齢者の糖尿病に対する注目が高まっています。今回は、あえて高齢者以外、特に新生児~若年発症糖尿病について焦点をあててみたいと思います。
日常臨床で家族歴に着目すると、時々、「家族みんな糖尿病です」「血縁者の多くが糖尿病なんです」「母方家系みんな糖尿病です」「子供の頃から糖尿病です」「生まれた時から糖尿病と聞いてます」など、稀ではありますが遭遇します。家族歴で糖尿病の集積が多いと、遺伝子異常による糖尿病が想起されます。単一遺伝子異常による糖尿病としては下記のようなものが有名です。
また、母方家系で糖尿病家族歴が濃厚の場合は、ミトコンドリア糖尿病の可能性があります。ミトコンドリア糖尿病の特徴は下記のようなものです。
また、「子供の頃から糖尿病」の場合、10歳未満の場合はほとんど1型糖尿病。10歳以降の糖尿病は1型、2型どちらの型もありとの報告があります(Uchigata-Y et al.: DRCP82 p80-86, 2008)。さらに「生まれた時から糖尿病」という場合、新生児糖尿病が疑われます。
新生児糖尿病は、生後6ヶ月未満に発症し、高血糖あるいはケトアシドーシスの発症を契機に発見され、長らく発症メカニズムの詳細は不明であり、治療にはインスリン療法が必須であるとされてきた稀な疾患です。近年、膵β細胞インスリン分泌調節に重要な役割を担うATP感受性K+(ATP)チャネルの構成サブユニットであるKir6.2およびSUR1の各遺伝子異常、さらにはインスリン遺伝子の異常が、新生児糖尿病の発症原因となり得ることが明らかとなりました。Kir6.2遺伝子(KCNJ11)は京都大学の稲垣暢也教授がクローニングし1995年にScience誌に発表された遺伝子です。このKir6.2およびSUR1遺伝子異常が新生児糖尿病発症に関与すること、これまで新生児糖尿病患者に対しては、生涯、インスリン治療が必要とされ、患者本人および家族の精神的・身体的負担は多大であったところを、症例によってはインスリン療法から経口血糖降下薬SU薬への治療法変更が可能であることが判明し、新生児糖尿病に対する治療法選択枝が広がったことは近年の大きなトピックスとなっています。さらに、遺伝子変異の部位によっては、何種類もあるSU薬のなかでも薬剤間に効果の差があることが報告され、さらにその薬効評価は患者投与前のin vitro実験で推定し得ることが報告されました。
新生児糖尿病に関して、まとめますと下記の様になります。
現時点では、すべての症例に、遺伝子変異スクリーニング、変異遺伝子に関するin vitro機能解析等をすることは困難ですが、今後の知見の集積と解析法の進歩に期待したいと思います。
岐阜大学大学院医学研究科 分子・構造学講座内分泌代謝病態学分野 教授
矢部 大介 氏

日本人2型糖尿病は、膵β細胞からのインスリン分泌障害を特徴とすることから、インスリン分泌是正に向けた治療戦略として、インクレチンにもとづく糖尿病治療薬が注目されてきた(JDI Suppl 1:102-9, 2016)。インクレチン(GIP、GLP-1)は、血糖依存的に膵β細胞からインスリン分泌を促進するため、低血糖リスクが低い(JDI 1(1): 8-23, 2010)。実際、筆者らはインクレチン関連薬であるDPP-4阻害薬やGLP-1受容体作動薬について、高血糖時に認めるインスリン分泌促進能が低血糖時に消失することを確認している(DOM 19(3):442-447, 2017)。また、高齢者2型糖尿病患者を対象にしたランダム化比較試験や健康保険データを活用したリアルワールドエビデンス研究を通して、DPP-4阻害薬が低血糖リスクを上昇させることなく血糖コントロールを是正可能なことを報告している(DOM 19(8):1188-1192, 2017; DOM 17(4):430-434, 2015)。
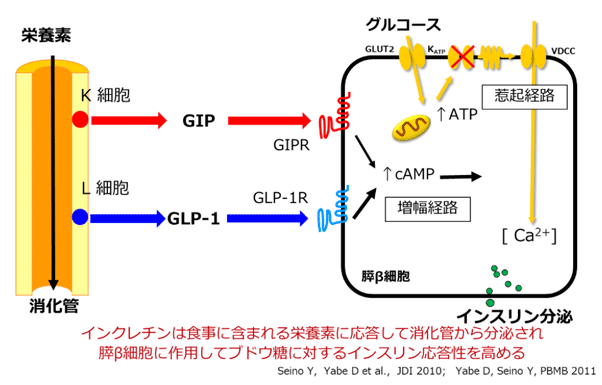
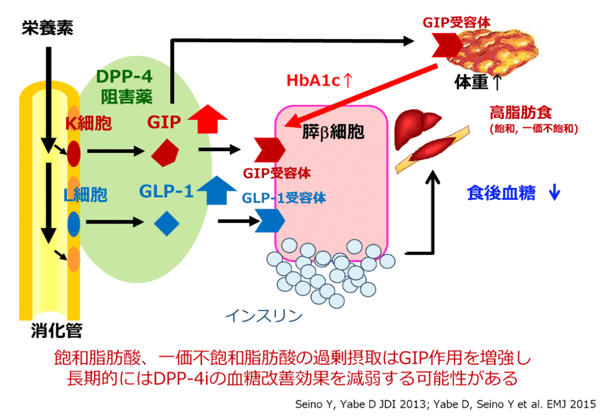
健康保険データを用いてDPP-4阻害薬が、他の経口治療薬と比して、処方開始後から治療強化(他薬追加、インスリンやGLP-1受容体作動薬への変更)までの期間が長いことを明らかにしている。高齢者糖尿病患者が約7割を占めるわが国では、DPP-4阻害薬が事実上、有効かつ安全な第1選択薬として使用されるにいたる(JDI Suppl 1:102-9, 2016)。しかし、DPP-4阻害薬の長期成績をみると、開始3~6ヶ月後に血糖改善効果が減弱する例が散見される(JDI 5(4): 445-448, 2014)。このような症例の特徴として、DPP-4阻害薬開始後、体重増加をきたすため、著者らは慣習的に摂取する食事内容がDPP-4阻害薬の血糖改善効果と関与する可能性を考えた。事実、著者らはDPP-4阻害薬を開始した患者の食事内容を検討することで、DPP-4阻害薬を使用中にHbA1c改善効果が減弱する患者では、摂取エネルギー量過剰に加え、GIP分泌を強く促進する飽和脂肪酸や一価不飽和脂肪酸の摂取量が多いことを明らかにしている(JDI 9(5):1153-1158, 2018)。DPP-4阻害薬の血糖改善作用に対するGIPの重要性が明確化される一方、高脂肪食負荷時にはGIPが脂肪蓄積を助長することを考慮すれば(JDI 4(2): 108-130, 2013)、長期にDPP-4阻害薬の血糖改善効果を持続させるには、飽和脂肪酸を多く含む食事を控えるような栄養指導が推奨されると考える(図2)。
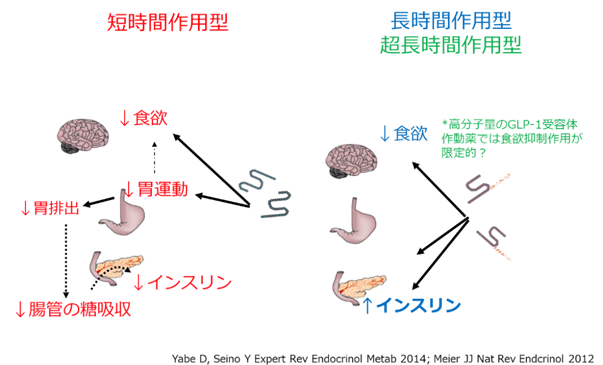
近年、大規模臨床試験において心保護、腎保護効果が示され(JDI 8(3): 272–276, 2017)、GLP-1受容体作動薬の処方例がわが国でも増加している。GLP-1受容体作動薬は、アメリカドクトカゲ由来のペプチドexendin 4をベースとしたものとヒトGLP-1をベースにしたものに分類されるが、近年、生体内での作用機序で分類することが多い。著者らのグループは、短時間作用型(エキセナチド、リキシセナチド)は胃運動を抑制することで血糖上昇を抑制する一方、長時間作用型(リラグルチド)、超長時間作用型(エキセナチドLAR、デュラグルチド、セマグルチド等)はインスリン分泌を是正することで血糖を是正することを示している(図3)。GLP-1受容体作動薬は食欲中枢に作用して減量効果を発揮するが、大変興味深いことに一部の超長時間作用型は減量効果が他に比較して小さい。現時点で十分なエビデンスはないが、週1回注射で十分な血糖改善効果を発揮させるべく、免疫グロブリンやアルブミンと融合させた高分子量のGLP-1受容体作動薬は中枢への移行がよくなく、減量効果が小さいことが指摘されている。若齢の肥満2型糖尿病では、減量効果の大きなGLP-1受容体作動薬が注目される一方、サルコペニアのリスクが高い高齢者2型糖尿病では減量効果の小さい製剤が使いやすいかもしれない。
さて、著者らはGLP-1受容体作動薬の血糖改善効果を検討する過程で残存する膵β細胞機能が重要であることを明らかにしている(JDI 4(6):585-594, 2013; JDIC 29(8):1304-9, 2015; JDIC 30(7):1385-92, 2016; JDI 9(4):822-830, 2018)。残念ながら膵β細胞は加齢と共に増殖能を失うため、GLP-1受容体作動薬による血糖改善効果を十分に発揮するには、膵β細胞が十分に残存する発症早期に導入する必要がある。
DPP-4阻害薬やGLP-1受容体作動薬に加えて、近年、GIPやGLP-1、さらにはグルカゴンの受容体をひとつのペプチドで活性化するデュアルアゴニストやトリプルアゴニストが肥満2型糖尿病の治療薬として開発途上にある(JDI 10(5):1171-1173, 2019)。また、GLP-1受容体作動薬は、注射薬であるがゆえに導入にあたり障壁があったが、胃粘膜からペプチド吸収を可能にする脂肪酸誘導体SNACを用いることで経口投与可能になる製剤も開発がすすめられている。GLP-1受容体やGIP受容体の遺伝子多型とインクレチン関連薬の血糖改善効果の関連について研究がすすめられており、新規インクレチン関連薬と共に、今後、個々の患者に最適な個別化医療の提供がより可能になると考える。さて、DPP-4阻害薬、GLP-1受容体作動薬共に、上市直後から議論されてきた急性膵炎や膵疾患について、当局からは現在の治療に関する推奨事項を修正するには情報が不十分という見解が発表されている。わが国の健康保険データを用いた我々の解析においても、DPP-4阻害薬による急性膵炎リスクの上昇は認めなかった(DOM 17(4):430-434, 2015)。しかし、心血管安全性試験のメタ解析からDPP-4阻害薬は極めて稀であるが軽微なリスク上昇が示唆されている。DPP-4阻害薬の使用が一般化される中、類天疱瘡等との関係を示唆する報告もなされており(JDI 10(5):1168-1170, 2019)、因果関係や患者の特徴について引き続き検討する必要があろう。インクレチン薬の登場により、糖尿病治療は大きな変革してきた。今後、経口投与可能なGLP-1受容体作動薬が登場するなどインクレチン薬による治療のさらなる普及が期待されるなか、今一度、安全性や有効性に関する知見を振り返り、日常の糖尿病診療に活用する必要がある。
群馬大学 生体調節研究所 代謝シグナル研究展開センター センター長
北村 忠弘 氏

インスリンとグルカゴンの作用を一言で表すと、インスリンは同化作用でグルカゴンは異化作用である。つまり、インスリンは食事から摂取したグルコースやアミノ酸といった栄養素を血中から細胞内に取り込ませ、それを元にしてグリコーゲンや蛋白質、脂肪を合成している。一方、グルカゴンは細胞内に貯えたグリコーゲンや脂肪を分解させ、グルコースや脂肪酸、ケトン体といったエネルギー源を産生している。両ホルモンの作用は逆向きの作用が多く、インスリンとグルカゴンは拮抗ホルモンであるという印象を受けるが、必ずしも逆向きの作用だけでない。つまり、腎臓や中枢神経系においてはNaや水の再吸収、食欲抑制など、両ホルモンは同じ作用を示す。さらに、骨格筋にはグルカゴン受容体は発現しておらず、インスリンの骨格筋に対する作用にグルカゴンは拮抗しない。従って、グルカゴンを単純にインスリンの拮抗ホルモンとする考え方は改めなければならない。
インスリンがBantingとBestによって犬の膵臓抽出物から発見されたのが1921年で、その2年後の1923年にKimballとMurlinがインスリンの粗精製物中に血糖上昇物質が含まれていることを発見し、グルカゴンと名付けた。その後、1953年にインスリンの、1957年にグルカゴンの一次構造が解明され、それぞれ51アミノ酸、29アミノ酸配列が確定した。さらに、1959年にインスリンとグルカゴンのラジオイムノアッセイ(RIA)がほぼ同時期に開発され、両ホルモンの研究は急速に進展した。しかしながら、その後の半世紀はインスリン研究が主流となり、グルカゴン研究に大きく差をつけ、あたかもインスリンが主役、グルカゴンは脇役のイメージが定着してきた。グルカゴン研究が進まなかった最大の理由は測定系が不正確だったからである。世界的に普及している8種類のグルカゴン測定キットを比較した結果が発表されたが、どれ一つ感度、特異性に優れたものはなかったという結論である。グルカゴン測定が困難な理由として、プログルカゴンからプロセッシングを受けて合成される過程で、グルカゴン類縁ペプチドと呼ばれるグルカゴンとアミノ酸配列が類似した複数のペプチドが合成されることがある。これはプロインスリンからインスリンとC-ペプチドの2つしか合成されないのとは対照的である。特に、グリセンチンやオキシントモジュリンはアミノ酸配列がグルカゴンと重複しており、従来のグルカゴンC末抗体を用いた競合法RIAでは交叉反応を起こしてしまう。この問題を克服するために、N末抗体とC末抗体の両方を用いたサンドイッチELISA法が開発され、グルカゴンに対する特異性が飛躍的に向上した。しかしながら、この方法でもグルカゴンに対する特異性が十分でない。即ち、従来法の競合法RIAに比べると、グルカゴンに対する特異性は増したが、サンドイッチELISAといえども原理はイムノアッセイであり、抗体による非特異性反応を100%除外することはできない。従って、筆者らはイムノアッセイ原理を用いない新たな測定法として、質量分析を用いたグルカゴン測定系(LC-MS/MS)を開発した。しかしながら、全ての検体をLC-MS/MSで測定できるかというと、現時点では以下の理由から困難である。まず、イムノアッセイと違って機器が高額であること、さらに、複数検体を同時に測定することができず、測定に時間がかかり過ぎるからである。従って、LC-MS/MSの測定値に近い値を示すイムノアッセイを探索したところ、サンドイッチELISAが従来法の競合法RIAより近い値であることが判明した。従って、今後はグルカゴンの測定はサンドイッチELISAを用いて行われるべきであり、これまでのグルカゴンに関するデータもサンドイッチELISAで再評価して、糖尿病におけるグルカゴンの新たな病態生理的意義の解明へとつなげていくべきである。将来的には、グルカゴンも視野に入れた糖尿病の病態診断と、それを基にした新たな治療戦略の開発に期待がかかる。
健康な人に糖負荷や食事負荷をした際の血糖値、血中インスリン濃度の変化と合わせて、3種類の測定系で血中グルカゴン濃度を評価したところ、血糖値とインスリンに関しては、糖負荷(75gブドウ糖)と食事負荷(約50g炭水化物、約20gタンパク質、約10g脂質)では、ほぼ類似の変動パターンを示したのに対し、グルカゴンはLC-MS/MSとサンドイッチELISAの両方において、糖負荷と食事負荷では逆の変動パターンを示し、糖負荷でグルカゴンは有意に低下するが、食事負荷では上昇した。重要なことに、これらの逆パターンは従来の競合法RIAでは認められなかった。従って、従来の測定法による結果をもとに、食後はインスリン分泌が促進され、グルカゴン分泌は抑制されると考えられてきたが、それは誤りであり、食後はインスリンもグルカゴンも分泌が促進される。それでは、食後にグルカゴン分泌が促進される生理的意義は何であろうか? グルカゴンには中枢における食欲抑制、消化管運動抑制、褐色脂肪での熱産生促進などの作用があり、これらは全て食後に分泌促進した方が理にかなっている。すなわち、食後に摂食を止めさせる働きや、食事誘導性熱産生(食後には体温上昇や発汗が起こる)にグルカゴンが関わっているという考え方である。しかしながら、最近では、グルカゴンは食後のアミノ酸代謝に必須であるために分泌が促進されるのではないかと考えられるようになってきた。即ち、食事中のタンパク(アミノ酸)が分解されて生じるNH3(アンモニア)は生体に有害であり、これを尿素に変換して尿として体外に排出する目的で、食後にグルカゴン分泌が促進されるという考え方である(グルカゴンには尿素合成促進作用がある)。ちなみに糖新生の基質としてのアミノ酸はアラニンとグルタミンが主であるが、グルカゴンはグルタミンからの糖新生に深く関わっている。グルタミンはグルタミナーゼ(GLS2)とαケトグルタル酸脱水素酵素(αKGDH)によって代謝を受け、糖新生に回されるが、これらの酵素をグルカゴンが制御している。この際に、グルタミンからは2分子のアンモニアが生成され、カルバモイルリン酸合成酵素(CPS1)によって尿素に変換されるが、このCPS1もグルカゴンが制御している。一方、グルカゴンは肝臓の脂肪分解を促進し、さらに脂肪酸からアセト酢酸やβヒドロキシ酪酸を合成するHMG-CoAリアーゼを制御することで、ケトン体の合成にも関わっている。すなわち、グルカゴンは糖代謝調節に加えて、アミノ酸代謝や脂質代謝にも重要な役割を果たしており、血中グルカゴンの生理的動態も糖以外の栄養素によっても制御されている。
これまで、2型糖尿病における高グルカゴン血症の高血糖に対する寄与度はインスリン分泌不全やインスリン抵抗性に比べて小さいと考えられてきた。その理由の一つは、従来の測定系で検出された2型糖尿病患者の血中グルカゴン濃度は健常者に比べて軽度の上昇であり、さらに検体間のバリエーションが大きく、統計学的有意差がつきにくかったからである。このような背景から、2型糖尿病ではまずβ細胞機能障害が先行し、その後2次的にα細胞機能障害が惹起されるという考え方が主流であった。実際、β細胞から分泌されるインスリン、GABA、亜鉛が隣接するα細胞のグルカゴン分泌を抑制するという研究成果が多く存在するし、α細胞特異的インスリン受容体欠損マウスはグルカゴン分泌が障害されている。しかしながら、最近、筆者らはα細胞にはグルコース輸送体であるGLUT1と、グルコースとNa+の共輸送体であるSGLT1が発現していおり、高血糖や糖尿病状態では前者が減少し、後者が増加することでグルカゴン分泌が亢進するメカニズムを提唱している。このメカニズムは糖尿病では高血糖による糖毒性などでα細胞自体の糖輸送体に変化が生じ、α細胞の一元的な理由(cell autonomous)で高グルカゴン血症になるというもので、これまでのインスリン作用不足による二次的な影響ではないことを示唆している。
現在の糖尿病薬によるグルカゴン受容体への影響は多種多様である。インクレチン関連薬であるGLP-1受容体作動薬とDPP4阻害薬はグルカゴン分泌を抑制する。一方、ビグアナイド(メトホルミン)は肝臓におけるグルカゴン受容体シグナルを抑制することが明らかにされている。従って、ビグアナイドとDPP4阻害薬の併用や、これらの配合剤はグルカゴンに対しては相加的な効果が期待できる。反対にグルカゴン分泌を促進すると考えられているのがSU薬、グリニド薬、SGLT2阻害薬である。しかしながら、その機序については不明な点が多く、さらに薬剤によってはグルカゴン分泌を促進しないものもあり、今後の研究が必要である。著者らもSGLT2阻害薬間でグルカゴンに対する影響に違いがあり、その違いはα細胞に発現するSGLT1を阻害するか否かに起因することを報告した。つまり、SGLT2阻害薬間にSGLT2に対する選択性の違いがあり、選択性の低い薬剤はα細胞のSGLT1を阻害することでグルカゴン分泌に影響する。ちなみに、2015年にBonnerらによって提唱されたα細胞のSGLT2を直接阻害することによってグルカゴン分泌を促進するという仮説は、筆者らとHolstらにより否定された。
一方、グルカゴン受容体を阻害することで肝臓における糖産生を抑制し、血糖値を低下させる糖尿病薬の開発が進められている。例えば、グルカゴン受容体拮抗薬LY2409021は2型糖尿病患者への投与で、著明な血糖改善効果が認められている。しかしながら、LY2409021は体重増加、血圧上昇、脂肪肝、血清脂質上昇などの複数の副作用から、開発が中止されている。一方、グルカゴン受容体に対する中和抗体の開発も進んでおり、糖尿病モデルマウスを用いた動物実験レベルでは著明な血糖改善効果を示しながらもLY2409021に認められた副作用はなく、むしろ体重減少や脂肪肝の改善が認められたと報告されている。
今後、新規測定系を用いた糖尿病におけるグルカゴンの病態生理的意義の解明と、種々の糖尿病薬による血中グルカゴン濃度への影響の再検証を行い、将来的にはグルカゴンも視野に入れた糖尿病の病態診断と、グルカゴンを標的とした新たな糖尿病薬の開発が望まれる。
京都糖尿病医会会長
鍵本 伸二
会員の先生方に於かれましては、平素より糖尿病医会の会務にご協力頂き誠に有難うございます。この原稿を書いている時点では昨年末に中国から始まった新型コロナウイルス感染症(COVID-19)の影響が拡大し続けており、糖尿病医会に関連する各種会議や研究会、学会も軒並み中止となっております。会報がお手元に届くころにどうなっているのか、全く先が見通せませんが事態が少しでも好転していることを祈るばかりです。
さて、糖尿病診療においてはインスリンやGLP-1受容体作動薬の自己注射が古くから行われており、在宅自己注射指導管理料は馴染み深い先生方が多いことと思います。複数の在宅療養指導管理料を併せて算定することはできないという事もよく知られている通りです。インスリン自己注射をしている患者さんが慢性呼吸不全を合併して在宅酸素療法(HOT)が必要になったり、睡眠時無呼吸症候群を合併して持続陽圧呼吸療法(CPAP)が必要になったりした場合、他院に依頼するなどして在宅療養指導管理が複数になるのを避けてきましたが、そうも言っていられないケースが最近出てきましたので、少し勉強して引き受けることになりました。既にご存知の先生方にとっては何でもないことと思いますが、ご参考までに報告致します。2020年4月の点数改正以前の状況に基づいて書いていますことをご了承ください。
まず大原則として、保険請求の「在宅療養指導管理料」の項に「2つ以上の指導管理を行っても主たる指導管理の点数しか算定できない」とあります。指導管理料は主たるものをひとつだけですが、「加算」の部分は必要なものを両方算定することが出来ます。
在宅療養指導管理料は、在宅酸素療法指導管理料(2400点)>自宅自己注射指導管理料(750点 or 650点)ですので、主たるものとして在宅酸素療法指導管理料(2400点)を算定し、在宅酸素療法指導管理料に付随する各種加算は当然通常通り算定します。
在宅自己注射指導管理料は算定しませんが、血糖自己測定器加算や注入器加算、間歇注入シリンジポンプ加算など在宅自己注射に関連する加算だけを算定することが出来ます。当院でこの患者さんのレセプトの在宅の欄は以下のようになっています。
在宅療養指導管理料は、在宅自己注射指導管理料(750 or 650点)>在宅持続陽圧呼吸療法指導管理料2(250点)ですので、主たるものとして在宅自己注射指導管理料を算定し、それに付随する加算も通常通り算定します。
在宅持続陽圧呼吸療法指導管理料は算定しませんが、それに関連する加算は算定することが出来ます。この場合、在宅持続陽圧呼吸療法指導管理料を算定する時に必要な各種のコメントも省略せずに記載する必要があります。当院でこの患者さんのレセプトの在宅の欄は以下のようになっています。
1 在宅自己注射導入時の算定
月の途中から、初めて在宅自己注射指導管理料2を算定する場合は算定日から月の最終日までの指示回数にて算定する(たとえば、1日1回インスリン自己注射を指導、4月10日から初めて算定する場合は、「月27回以下;650点」を選択する)。
**自己注射回数が厳密に査定されるようになってきていますので注意・確認してください。
2 在宅自己注射指導管理中の算定
初回導入2月目以降に在宅自己注射指導管理料2を算定する場合は、月中のどのタイミングで算定したとしても、その月に指示した回数にて算定する(たとえば、4月10日に在宅自己注射指導管理料2を算定したとしても、4月1日から30日まで(=当該管理料の属する月)の指示回数で「月27回以下;650点」または「月28回以上;750点」を選択する)。
**仮に、月途中で他院へ転院されても、当該月の管理料は算定できます
血糖自己測定器加算については「血糖自己測定値に基づく指導を行うため自己測定器を使用した場合に」とあるため、本来使用した結果に基づき回数を決定すべきである。しかし、実際には患者が実際に行った検査回数を医師が把握することは困難なことから、医師が検査を指示した回数を記載し、当該加算点数を算定する。
**保健者から算定回数の記載がないとの理由で再審査請求があります
(文責 長谷川 剛二)